Cieľom projektu štúdie EPCS II je porovnanie klinického stavu pacientov, ktorí po splnení indikačných kritérií podstúpili epiduroskopický výkon.
Štúdia EuroPainClinics®Study II (EPCS II) objektivizuje prínos miniinvazívneho algeziologického výkonu – epiduroskopia u pacientov s bolesťami chrbta po jednej alebo viacerých neúspešných operáciách chrbtice s tzv. syndrómom zlyhania chirurgického výkonu na chrbtici ako liečebného postupu – failed back surgery syndrómom (FBSS). Je zameraná na sledovanie dlhodobej úľavy od bolesti a zlepšenie kvality života u týchto pacientov.
Dňa 23. 4. 2015 bola štúdia schválená regionálnou nemocničnou etickou komisiou pod číslom EK: 75 / EK / 15 . Následne bola zaregistrovaná v medzinárodnej databáze National Health Service USA. https://clinicaltrials.gov PRS: NCT02459392 . EPCS 2 Approval document Projekt spĺňa všetky atribúty a platné legislatívne normy týkajúce sa medicínskeho výkonu schváleného Ministerstvami zdravotníctva v SR a ČR.
Detail štúdie
EuroPainClinics®Study II (EPCS II) objektivizuje prínos miniinvazivného algeziologického výkonu – epiduroskopia.
Výkon epiduroskopia – indikačné kritéria
Štúdia EuroPainClinics®Study II (EPCS II) objektivizuje prínos miniinvazívneho algeziologického výkonu – epiduroskopie u pacientov s bolesťami chrbta, ktorí prekonali jednu alebo viacero neúspešných operácií chrbtice a trpia tzv. Syndrómom zlyhania chirurgickej liečby chrbta (failed back surgery syndrome – FBSS). Štúdia je zameraná na sledovanie dlhodobej úľavy od bolesti a na zlepšenie kvality života týchto pacientov.
Predmet studie EPCS II a registrácia
Predmetom projektu je realizácia multicentrickej dvojito zaslepenej randomizovanej klinickej štúdie zaoberajúcej sa porovnaním dvoch metodických postupov prevedení epiduroskopického výkonu u pacientov s FBSS.
Štúdia bola pripravená a vypracovaná organizáciou Europainclinics z.ú. po vypracovaní dizajnu štúdie, príprave informovaných súhlasov pre jej účastníkov a vyhotovenie protokolu bola štúdia 23. 4. 2015 schválená regionálneou nemocničnou etickou komisiou pod číslom EK: 75 / EK / 15 Následne bola zaregistrovaná v medzinárodnej databáze National Health Service USA https://clinicaltrials.gov PRS: NCT02459392.
Projekt spĺňa všetky atribúty a platné legislatívne normy týkajúce sa medicínskeho výkonu schváleného ministerstvami zdravotníctva v SR a ČR. Spracovanie osobných údajov pacientov za účelom vedenia štúdie je v súlade so súčasnou verziou Helsinskej deklarácie z roku 2008 a v súlade s príslušnými zákonmi danej krajiny. Bude zachovaná ochrana osobných údajov pacienta. S dátami sa bude nakladať podľa smerníc EU: Smernice 95/46/EC, Smernice 2002/58/EC, Smernice 2006/24/EC. Bude zaistené, aby protokol štúdie, informované súhlasy s intervenčným výkonom a s prebiehajúcou štúdiou boli podľa miestnych požiadaviek poskytnuté príslušnej nezávislej etickej komisii. V prípade, že to zákony danej krajiny vyžadujú, je spoločnosť EuroPainClinics z.ú. zodpovedná za poskytnutie každoročnej aktualizácie dokumentácie nezávislej etickej komisii. Výsledky dosiahnuté v štúdii budú publikované v odborných medzinárodných periodikách a zohľadnené v odporúčaniach a postupoch v klinickej praxi intervenčnej algeziológie.
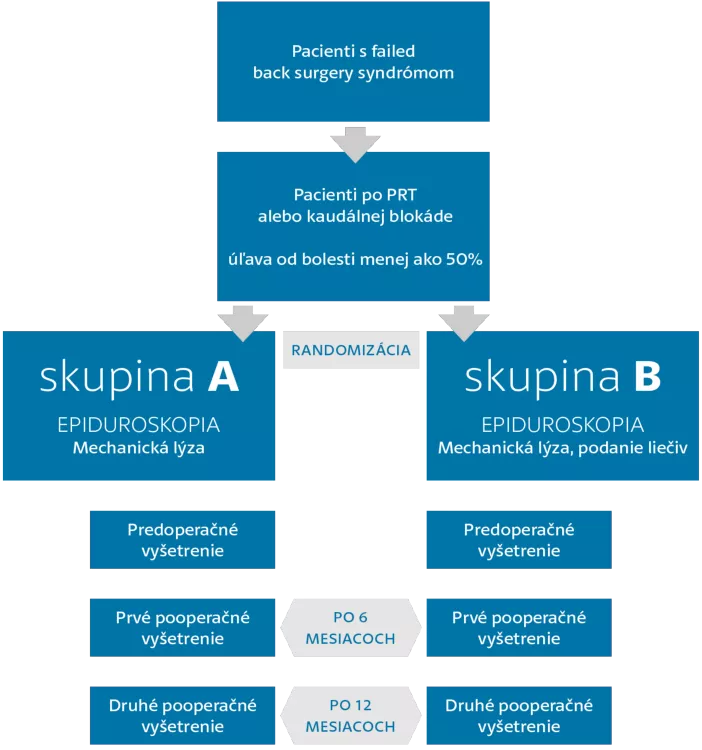
Priebeh štúdie EPCS II
Cieľom projektu bude porovnanie dvoch skupín pacientov, ktorí podstúpia epiduroskopický výkon. V skupine A pacientov – bude vykonaná počas epiduroskopie len mechanická lýza fibróznych zrastov. V skupine B pacientov sa súčasne vykoná mechanická lýza adhézií a podanie liečiv kortikoidu – depomedrolu a hyázy. Počas adhéziolýzy lekár cielene pod vizuálnou kontrolou ruší zrasty, ktoré sa upínajú na postihnutý nerv alebo duru. Môžu byť odstránené mechanicky – strhnutím špičkou vizuálne navádzaného epiduroskopu alebo tlakom pri preplachovaní fyziologickým roztokom. Medzi pokročilé metódy mechanického rušenia zrastov patrí lýza laserom a pulznou rádiofrekvenčnou abláciou. Lokálne podávané liečivá do epidurálneho priestoru počas výkonu a ich predpokladaný efekt: Hyáza sa môže podieľať na rušení zrastov, a to mechanizmom enzymatického štiepenia. Pri depomedrole sa predpokladá jeho protizápalový účinok v mieste podania a následná tendencia redukcie zápalovej odpovede, migrácie buniek, opuchu, bolesti a tvorby zrastov. Napriek týmto teoretickým predpokladom účinku podávaných liečiv doteraz nebol verifikovaný benefit vo výsledkoch odpublikovaných štúdií a preto podanie týchto liečiv sa považuje za diskutabilné.
Ciele štúdie EPC II a sledované parametre
Cieľom projektu je porovnanie klinického stavu pacientov, ktorí po splnení indikačných kritérií podstúpili epiduroskopický výkon a boli zaradení do štúdie EPCS II. Zo sledovaných parametrov sa bude porovnávať klinický stav, vizuálna škála bolesti, Globálne skóre bolesti, šírenie bolesti v príslušných dermatómoch, redukcia spotreby analgetík, Oswestry disability dotazník (poukazujúci na kvalitu života u pacientov s bolesťou lumbosakrálnej chrbtice). Sledované parametre budú zaznamenávané v troch časových periódach a to: pred výkonom (Prvé vyšetrenie), následne 6 mesiacov po výkone (Druhé vyšetrenie) a nakoniec 12 mesiacov po výkone (Tretie vyšetrenie). Výsledky budú následne podrobené štatistickej analýze. Ďalším cieľom projektu je zverejnenie zistených výsledkov v odborných medzinárodných periodikách.